Laboratoř imunoterapie
Vedoucí:
RNDr. Michal Šmahel, Ph.D.
Kde nás najdete:
Areál BIOCEV, Průmyslová 595, Vestec u Prahy, 252 50
1. nadzemní podlaží, křídlo 3 (místnosti 004, 007, 015, 017)
Výzkumná problematika
Laboratoř imunoterapie byla založena v roce 2015 skupinou pracovníků, kteří přestoupili z Ústavu hematologie a krevní transfúze a zapojili se jako výzkumný tým "Imunizace proti nádorům vyvolaným lidskými viry" do programu Buněčná biologie a virologie v tehdy nově vzniklém výzkumném centru BIOCEV ve Vestci u Prahy. Činnost laboratoře je zaměřena na imunoterapii nádorů vyvolaných viry, která je experimentálně testována na myších modelech nádorů, na jejichž vzniku se podílejí lidské papillomaviry.
 Při imunoterapii nádorů jsou používány protinádorové DNA vakcíny podávané biolisticky genovou pistolí. Tato imunizace je namířena zejména proti onkoproteinu E7 lidského papilomaviru typu 16. Pro posílení imunity CD8+ T lymfocytů byl vytvořen fúzní gen, nesoucí kromě onkogenu E7, mutovaného pro snížení onkogenního potenciálu, také univerzální pomocný epitop PADRE navržený in silico, který aktivuje CD4+ T buňky. Dalšího posílení imunity aktivované DNA vakcinací se snažíme dosáhnout stimulací buněk přirozené imunity. K tomu se nám osvědčily imunostimulační CpG motivy ve formě syntetického oligonukleotidu ODN1826. Ve spolupráci s Ústavem organické chemie a biochemie testujeme také agonisty proteinu STING.
Při imunoterapii nádorů jsou používány protinádorové DNA vakcíny podávané biolisticky genovou pistolí. Tato imunizace je namířena zejména proti onkoproteinu E7 lidského papilomaviru typu 16. Pro posílení imunity CD8+ T lymfocytů byl vytvořen fúzní gen, nesoucí kromě onkogenu E7, mutovaného pro snížení onkogenního potenciálu, také univerzální pomocný epitop PADRE navržený in silico, který aktivuje CD4+ T buňky. Dalšího posílení imunity aktivované DNA vakcinací se snažíme dosáhnout stimulací buněk přirozené imunity. K tomu se nám osvědčily imunostimulační CpG motivy ve formě syntetického oligonukleotidu ODN1826. Ve spolupráci s Ústavem organické chemie a biochemie testujeme také agonisty proteinu STING.
Samotná aktivace imunitních reakcí má obvykle jen omezený protinádorový účinek, protože v mikroprostředí nádorů se indukují různé mechanismy potlačující protinádorovou odpověď. Častým mechanismem je aktivace kontrolních bodů imunitní reakce, mezi které patří např. proteiny PD-1, CTLA-4 nebo TIM-3. Při imunoterapii proto používáme také monoklonální protilátky blokující tyto molekuly, což je postup, který se stále více úspěšně prosazuje i v klinické praxi. Jeho účinnost je však u většiny typů nádorů omezena jen na menší část pacientů. Příčinou mohou být další mechanismy, kterými nádorové buňky unikají imunitnímu systému hostitele.
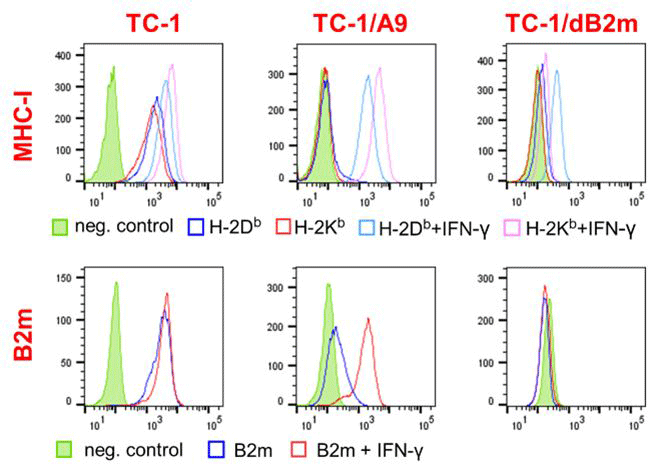 Hlavní protinádorový účinek protilátek blokujících receptory PD-1, CTLA-4 nebo TIM-3 spočívá ve zvýšení činnosti cytotoxických T lymfocytů rozpoznávajících nádorové buňky, které na svém povrchu prezentují epitopy navázané na molekuly hlavního histokompatibilního komplexu 1. třídy (MHC-I). Nádorům se však často daří vyhnout se zásahu těchto imunitních buněk díky genetické nestabilitě nádorových buněk a selekci jejich variant se sníženou expresí molekul MHC-I, což je jeden z nejvíce rozšířených únikových mechanismů lidských nádorů. Při vývoji myšího modelu jsme se proto zaměřili na odvození onkogenních buněčných klonů se sníženým množstvím molekul MHC-I exprimovaných na buněčném povrchu. Tato redukce může být buď reverzibilní, nebo ireverzibilní. Při reverzibilní změně, která je způsobena epigenetickými regulacemi, je možné povrchovou expresi molekul MHC-I obnovit indukcí např. interferonem γ (IFN-γ). Ireverzibilní změny jsou podmíněny genetickými mutacemi, které mohou mít různé fenotypové projevy. K úplné ztrátě povrchové exprese MHC-I dochází například při poruše produkce β2-mikroglobulinu. Nádorové klony s reverzibilně sníženou expresí molekul MHC-I se nám v minulosti podařilo získat z nádorů myší, ve kterých byly tyto klony přirozeně selektovány po DNA imunizaci proti onkoproteinu E7. Nově jsme připravili klony, ve kterých byl s použitím systému CRISPR-Cas9 inaktivován gen pro lehký řetězec (β2-mikroglobulin) nebo geny pro těžký řetězec MHC-I a je tak dosaženo ireverzibilní ztráty povrchové exprese MHC-I. Tyto klony nám umožní zlepšit účinnost imunoterapie proti částečně rezistentním nádorům, ale také studovat účinky β2-mikroglobulinu, který se může uplatňovat i jako růstový faktor a ovlivňovat tak chování nádorů a úspěšnost terapie.
Hlavní protinádorový účinek protilátek blokujících receptory PD-1, CTLA-4 nebo TIM-3 spočívá ve zvýšení činnosti cytotoxických T lymfocytů rozpoznávajících nádorové buňky, které na svém povrchu prezentují epitopy navázané na molekuly hlavního histokompatibilního komplexu 1. třídy (MHC-I). Nádorům se však často daří vyhnout se zásahu těchto imunitních buněk díky genetické nestabilitě nádorových buněk a selekci jejich variant se sníženou expresí molekul MHC-I, což je jeden z nejvíce rozšířených únikových mechanismů lidských nádorů. Při vývoji myšího modelu jsme se proto zaměřili na odvození onkogenních buněčných klonů se sníženým množstvím molekul MHC-I exprimovaných na buněčném povrchu. Tato redukce může být buď reverzibilní, nebo ireverzibilní. Při reverzibilní změně, která je způsobena epigenetickými regulacemi, je možné povrchovou expresi molekul MHC-I obnovit indukcí např. interferonem γ (IFN-γ). Ireverzibilní změny jsou podmíněny genetickými mutacemi, které mohou mít různé fenotypové projevy. K úplné ztrátě povrchové exprese MHC-I dochází například při poruše produkce β2-mikroglobulinu. Nádorové klony s reverzibilně sníženou expresí molekul MHC-I se nám v minulosti podařilo získat z nádorů myší, ve kterých byly tyto klony přirozeně selektovány po DNA imunizaci proti onkoproteinu E7. Nově jsme připravili klony, ve kterých byl s použitím systému CRISPR-Cas9 inaktivován gen pro lehký řetězec (β2-mikroglobulin) nebo geny pro těžký řetězec MHC-I a je tak dosaženo ireverzibilní ztráty povrchové exprese MHC-I. Tyto klony nám umožní zlepšit účinnost imunoterapie proti částečně rezistentním nádorům, ale také studovat účinky β2-mikroglobulinu, který se může uplatňovat i jako růstový faktor a ovlivňovat tak chování nádorů a úspěšnost terapie.
 Nádorové buňky se sníženou expresí molekul MHC-I jsou sice necitlivé k působení cytotoxických T lymfocytů, zvyšuje se však u nich většinou citlivost k zásahu NK buňkami a mohou být zničeny i dalšími buňkami přirozené imunity, např. makrofágy. Zabýváme se proto vývojem kombinovaných imunoterapeutických postupů, které by aktivovaly různé buňky adaptivní a přirozené imunity a byly tak účinné proti nádorovým buňkám s rozdílnou mírou exprese molekul MHC-I. Jedním z cílů kombinované imunoterapie tak je přeměna pronádorových makrofágů typu M2 na protinádorové makrofágy typu M1, které by mohly být účinné i při inhibici růstu nádorů vyvolaných buňkami s redukcí molekul MHC-I.
Nádorové buňky se sníženou expresí molekul MHC-I jsou sice necitlivé k působení cytotoxických T lymfocytů, zvyšuje se však u nich většinou citlivost k zásahu NK buňkami a mohou být zničeny i dalšími buňkami přirozené imunity, např. makrofágy. Zabýváme se proto vývojem kombinovaných imunoterapeutických postupů, které by aktivovaly různé buňky adaptivní a přirozené imunity a byly tak účinné proti nádorovým buňkám s rozdílnou mírou exprese molekul MHC-I. Jedním z cílů kombinované imunoterapie tak je přeměna pronádorových makrofágů typu M2 na protinádorové makrofágy typu M1, které by mohly být účinné i při inhibici růstu nádorů vyvolaných buňkami s redukcí molekul MHC-I.
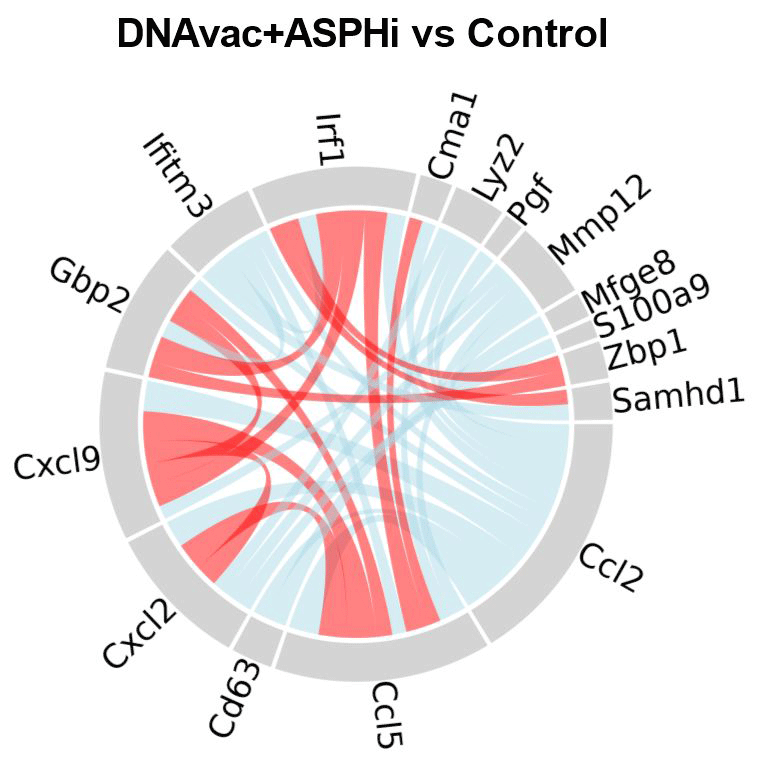 Mikroprostředí nádoru je složitým komplexem různých typů buněk, které se rozličnými mechanismy podílejí na vývoji nádorů nebo naopak přispívají k protinádorovým reakcím. Jedním z našich cílů je i charakterizace těchto mechanismů a sledování jejich ovlivnění imunoterapeutickými postupy. Provádíme proto izolaci buněk z nádorů a jejich charakterizaci průtokovou cytometrií a sekvenováním RNA v jednotlivých buňkách. Zaměřujeme se také na prostorovou heterogenitu nádorů, a to jak z hlediska nádorových buněk (v našem modelu nám jde zejména o heterogenitu exprese MHC-I), tak i z hlediska imunitních buněk.
Mikroprostředí nádoru je složitým komplexem různých typů buněk, které se rozličnými mechanismy podílejí na vývoji nádorů nebo naopak přispívají k protinádorovým reakcím. Jedním z našich cílů je i charakterizace těchto mechanismů a sledování jejich ovlivnění imunoterapeutickými postupy. Provádíme proto izolaci buněk z nádorů a jejich charakterizaci průtokovou cytometrií a sekvenováním RNA v jednotlivých buňkách. Zaměřujeme se také na prostorovou heterogenitu nádorů, a to jak z hlediska nádorových buněk (v našem modelu nám jde zejména o heterogenitu exprese MHC-I), tak i z hlediska imunitních buněk.
Laboratoř se zabývá také enzymem aspartát β-hydroxyláza (ASPH). Zkoumáme jednak jeho zapojení do signalizačních drah karcinogeneze u různých typů nádorů a dále ho využíváme jako terapeutický cíl, kdy inhibujeme jeho enzymatickou aktivitu pomocí nízkomolekulárních inhibitorů. Protože jsme prokázali, že inhibice ASPH zvyšuje adaptivní imunitní odpověď indukovanou DNA vakcinací, snažíme se o zapojení inhibitorů ASPH do kombinované imunoterapie nádorů a zároveň usilujeme o objasnění mechanismů, kterými inhibice ASPH přispívá k posílení imunitní odpovědi.
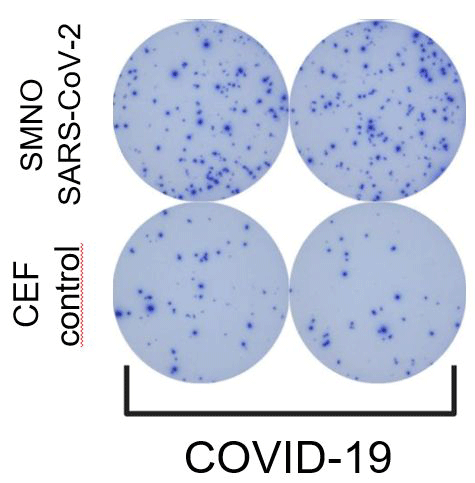 Během pandemie covidu-19 jsme vyvinuli testy ELISPOT pro detekci paměťových T a B lymfocytů specifických pro SARS-CoV-2. Tyto testy jsme použili pro analýzu imunitní odpovědi u pacientů s různou závažností onemocnění covid-19.
Během pandemie covidu-19 jsme vyvinuli testy ELISPOT pro detekci paměťových T a B lymfocytů specifických pro SARS-CoV-2. Tyto testy jsme použili pro analýzu imunitní odpovědi u pacientů s různou závažností onemocnění covid-19.





















