Laboratoř fyziologie bakterií
Vedoucí:
doc. RNDr. Radovan Fišer, Ph.D.
Katedra genetiky a mikrobiologie
Poradce pro studium a garant magisterského studijního programu a doktorského studijního programu Mikrobiologie
Viničná 5, 2NP, místnost 103
Viničná 5, 2NP, místnost 104
Kde nás najdete:
Budova Viničná 5, Praha 2 - Nové Město, 128 43
1. patro (místnosti 101, 103, 104, 104a, 104b, 104c, 110, 124), suterén (místnost S11, S11a, S11b)
Výzkumná problematika
Další informace lze nalézt i na adrese http://web.natur.cuni.cz/~konop/contact.php
 Laboratoř fyziologie bakterií se zabývá funkcí bakteriálních toxinů, které působí na cytoplazmatickou membránu cílové buňky. Dále se zabývá adaptací bakteriální membrány ke stresům a její interakcí s povrchově aktivními látkami a interakcí bakteriálních buněk s nanomateriály. Skupina využívá kromě tradičních mikrobiologických přístupů pestrou škálu biofyzikálních metod: metody založené na fluorescenční spektroskopii a mikroskopii, vodivostní měření na lipidových dvojvrstvách, rentgenostrukturní analýzu, metody analytické chemie (plynová a kapalinová chromatografie) a výpočetní metody pro stanovení struktur proteinů.
Laboratoř fyziologie bakterií se zabývá funkcí bakteriálních toxinů, které působí na cytoplazmatickou membránu cílové buňky. Dále se zabývá adaptací bakteriální membrány ke stresům a její interakcí s povrchově aktivními látkami a interakcí bakteriálních buněk s nanomateriály. Skupina využívá kromě tradičních mikrobiologických přístupů pestrou škálu biofyzikálních metod: metody založené na fluorescenční spektroskopii a mikroskopii, vodivostní měření na lipidových dvojvrstvách, rentgenostrukturní analýzu, metody analytické chemie (plynová a kapalinová chromatografie) a výpočetní metody pro stanovení struktur proteinů.
 Bakterie exportují do svého okolí toxiny, které mohou drasticky změnit chování cílových buněk a způsobit jejich smrt. Laboratoř se zabývá proteinovými toxiny patogenních bakterií a jejich interakcemi s membránami cílových buněk hostitele. Dlouhodobě se věnuje adenylátcyklázovému RTX toxinu (CyaA) původce černého kašle Bordetella pertussis. Toxin CyaA svými aktivitami inhibuje imunitní odpověď cílových buněk. Laboratoři se ve spolupráci s Laboratoří molekulární biologie bakteriálních patogenů (Mikrobiologický ústav AV ČR, v.v.i.) vedenou prof. Peterem Šebem podařilo navrhnout model interakce CyaA s membránou napadené buňky, vysvětlit význam vstupu vápenatých a úniku draselných iontů z cílových buněk a také zmapovat osud toxinu po vstupu do membránových raftů a do nitra fagocytů. Laboratoř se dále spolupodílí na výzkumu 3D struktury C-koncové RTX domény CyaA a dalších příbuzných RTX toxinů, která má zásadní význam pro zaujetí jejich správné konformace. Výsledky výzkumu CyaA toxinu mohou být prakticky využitelné v lidské medicíně. Modifikovaný toxin je schopen do buněk imunitního systému dopravit antigeny pocházející z virů, bakterií a parazitů a indukovat v nich imunitní odpověď. Optimálně upravený toxin CyaA zbavený svých enzymatických aktivit bude součástí nově vyvíjené subjednotkové vakcíny proti černému kašli, jehož výskyt v rozvinutých zemích nebezpečně roste.
Bakterie exportují do svého okolí toxiny, které mohou drasticky změnit chování cílových buněk a způsobit jejich smrt. Laboratoř se zabývá proteinovými toxiny patogenních bakterií a jejich interakcemi s membránami cílových buněk hostitele. Dlouhodobě se věnuje adenylátcyklázovému RTX toxinu (CyaA) původce černého kašle Bordetella pertussis. Toxin CyaA svými aktivitami inhibuje imunitní odpověď cílových buněk. Laboratoři se ve spolupráci s Laboratoří molekulární biologie bakteriálních patogenů (Mikrobiologický ústav AV ČR, v.v.i.) vedenou prof. Peterem Šebem podařilo navrhnout model interakce CyaA s membránou napadené buňky, vysvětlit význam vstupu vápenatých a úniku draselných iontů z cílových buněk a také zmapovat osud toxinu po vstupu do membránových raftů a do nitra fagocytů. Laboratoř se dále spolupodílí na výzkumu 3D struktury C-koncové RTX domény CyaA a dalších příbuzných RTX toxinů, která má zásadní význam pro zaujetí jejich správné konformace. Výsledky výzkumu CyaA toxinu mohou být prakticky využitelné v lidské medicíně. Modifikovaný toxin je schopen do buněk imunitního systému dopravit antigeny pocházející z virů, bakterií a parazitů a indukovat v nich imunitní odpověď. Optimálně upravený toxin CyaA zbavený svých enzymatických aktivit bude součástí nově vyvíjené subjednotkové vakcíny proti černému kašli, jehož výskyt v rozvinutých zemích nebezpečně roste.
Na rozdíl od toxinů patogenních bakterií, které inhibují funkce hostitele, je cílem dalších proteinových toxinů - kolicinů enterobakterií - usmrcení okolních blízce příbuzných bakterií. V oblasti výzkumu kolicinů se skupině ve spolupráci s Laboratoří bakteriální genetiky a genomiky (Lékařská fakulta Masarykovy univerzity, Brno), vedené prof. Šmajsem, podařilo prokázat pórotvorný charakter u vybraných nově objevených enterobakteriálních kolicinů.
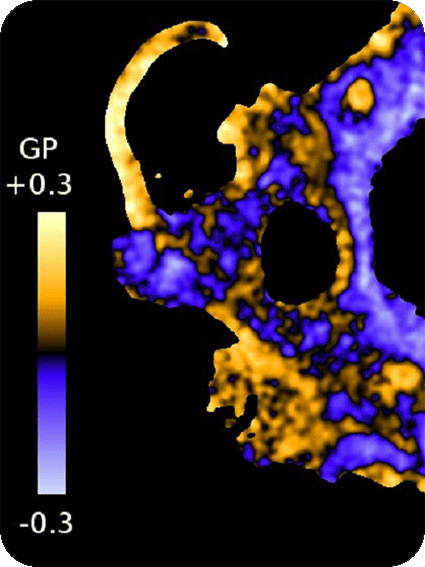 Bakterie jsou vynikajícími modelovými organizmy, které velmi rychle a účinně reagují na změny podmínek prostředí. Velmi častým důsledkem této adaptace jsou změny složení membrány měnící její tekutost, náboj a další fyzikální vlastnosti. Membrána bakterií je zároveň doposud plně nevyužitým cílem antibiotik. Laboratoř dlouhodobě studuje různé stresové adaptace u modelové půdní bakterie Bacillus subtilis – příkladem je adaptace složení membrány B. subtilis vyvolaná jeho vlastní produkcí lipopeptidového antibiotika surfaktinu a výzkum samotné interakce surfaktinu s membránou. Surfaktin je slibným kandidátem pro budoucí klinické využití, ale mechanizmus jeho účinku ani mechanizmus rezistence jeho producenta k této membránově aktivní molekule nejsou zatím vyřešeny. Kromě dalších stresů je dlouhodobě studována chladová adaptace B. subtilis pomocí membránové desaturázy mastných kyselin a také chladová adaptace u druhů rodu Bordetella v souvislosti s indukcí faktorů virulence po přechodu do hostitele.
Bakterie jsou vynikajícími modelovými organizmy, které velmi rychle a účinně reagují na změny podmínek prostředí. Velmi častým důsledkem této adaptace jsou změny složení membrány měnící její tekutost, náboj a další fyzikální vlastnosti. Membrána bakterií je zároveň doposud plně nevyužitým cílem antibiotik. Laboratoř dlouhodobě studuje různé stresové adaptace u modelové půdní bakterie Bacillus subtilis – příkladem je adaptace složení membrány B. subtilis vyvolaná jeho vlastní produkcí lipopeptidového antibiotika surfaktinu a výzkum samotné interakce surfaktinu s membránou. Surfaktin je slibným kandidátem pro budoucí klinické využití, ale mechanizmus jeho účinku ani mechanizmus rezistence jeho producenta k této membránově aktivní molekule nejsou zatím vyřešeny. Kromě dalších stresů je dlouhodobě studována chladová adaptace B. subtilis pomocí membránové desaturázy mastných kyselin a také chladová adaptace u druhů rodu Bordetella v souvislosti s indukcí faktorů virulence po přechodu do hostitele.
Nanomateriály různého složení se v současnosti stále více používají v biomedicínských aplikacích, například k úpravě povrchu implantátů, pro dopravu léčiv do organizmu, či jako substráty ve tkáňovém inženýrství. U nově vyvíjených nanomateriálů se často usiluje o optimální kombinaci protichůdných vlastností. Tou je biokompatibilita vzhledem k eukaryotním buňkám a naopak takové povrchové vlastnosti, které by zabránily růstu kontaminujících mikroorganizmů, tedy antiadhezivní a antibakteriální charakter jejich povrchu. Výhodou uhlíkových nanomateriálů, které skupina studuje, je možnost jejich funkcionalizace, při které se mění jejich vlastnosti připojením funkčních skupin k uhlíkovým atomům. Skupina se v úzké spolupráci se Skupinou růstu diamantů (Oddělení polovodičů, Fyzikální ústav AV ČR, v.v.i.), vedenou ing. Alexandrem Kromkou, zabývá výzkumem antibakteriálních vlastností uhlíkových nanomateriálů a mechanizmem jejich účinku na modelové bakterie. Dalšími materiály, jejichž antibakteriální vlastnosti se v současnosti studují, jsou nanokompozitní povlaky na bázi nanostříbra a plazmových polymerů, jejichž výrobou a výzkumem se zabývá skupina doc. Ondřeje Kyliána v Oddělení fyziky vrstev a povrchů makromolekulárních struktur na katedře makromolekulární fyziky MFF UK.





















