Zaměření skupiny Molekulární biologie rostlin
CO ZKOUMÁME? V našem týmu se věnujeme především výzkumu rostlinné epigenetiky. Zajímá nás, jakými způsoby mohou malé interferující RNA (siRNA) v součinnosti s komplexy RNA polymerázy II a RNA polymerázy V ovlivňovat stav chromatinu a genovou expresi. Zkoumáme i to, jak siRNA a stav chromatinu ovlivňují opravy zlomů DNA a mutagenezi indukovanou pomocí CRISPR/Cas.
PROČ TO ZKOUMÁME? Detailní pochopení mechanismů regulace aktivity chromatinu a její role v regulaci genové exprese a opravách DNA je zcela zásadním předpokladem pro pochopení fungování živých organismů a evoluce rostlinných genomů. Získané poznatky mají i biotechnologický význam, neboť mohou pomoci s řešením problémů spojených s genetickými modifikacemi zemědělských plodin, jež jsou často komplikovány umlčováním vnesených transgenů pomocí siRNA. Cílené editace genomů plodin jsou zase často zatíženy nízkou účinností mutageneze a obtížnou predikovatelností výsledných změn sekvence DNA, neboť obojí ovlivňuje i stav chromatinu.
KDO FINANCUJE NÁŠ VÝZKUM, KDO JEJ PROVÁDÍ A KDE SE O NĚM DOČTETE? Náš výzkum byl a je podporován z velkých výzkumných projektů typu NPUI či OP JAK. Naši studenti celkem pravidelně získávají projekty GAUK a v současnosti řešíme dva projekty GAČR. Do výzkumu jsou zapojeni studenti všech stupňů studia (bakalářského, magisterského i postgraduálního). Krom toho se do práce týmu zapojují i středoškolští studenti v rámci SOČ a zahraniční stážisti v rámci programu Erasmus. Výsledky našeho výzkumu publikujeme v renomovaných vědeckých časopisech zpravidla v prvním kvartilu našeho oboru.
JAKÉ VYUŽÍVÁME METODY? Při studiu využíváme molekulárně biologické postupy včetně těch nejmodernějších, jako je příprava geneticky modifikovaných rostlin (transgenoze), editace genomů pomocí CRISPR/Cas, chromatinová immunoprecipitace (ChIP), izolace malých RNA a nascentních transkriptů RNA polymerázy II a s nimi spojené analýzy Next-generation sequencing (NGS) dat, koimunoprecipitace (Co-IP) a následné analýzy proteomických dat, analýzy metylace DNA a mnoho dalších. Seznam většiny metod, používaných v naší laboratoři naleznete ZDE.
CHCETE VĚDĚT VÍCE, CHCETE SE K NÁM PŘIDAT? Pro více informací o naší skupině, možnostech vypracování bakalářské, diplomové či disertační práce v naší laboratoři kontaktujte vedoucího skupiny Lukáše Fischera či postdoky Adélu Přibylovou a Vojtu Čermáka (e-mailem nebo se stavte přímo v naší laboratoři ve Viničné 5, 2. patro, dveře 210 na konci chodby vlevo).
Další témata řešená v naší skupině |
|
|
Glutaminsyntetáza GS2 v A. thaliana a její role ve fotorespiraci a primární asimilaci dusíku |
Genetické a epigenetické příčiny auxinové autonomie tabákových buněčných linií |
|
Isoformy proteinu PsbO a jejich role ve fotochemické fázi fotosyntézy u A. thaliana |
Regulátor G-proteinová signalizace RGS1 a jeho role ve vývoji bramboru |
Úvod do epigenetiky
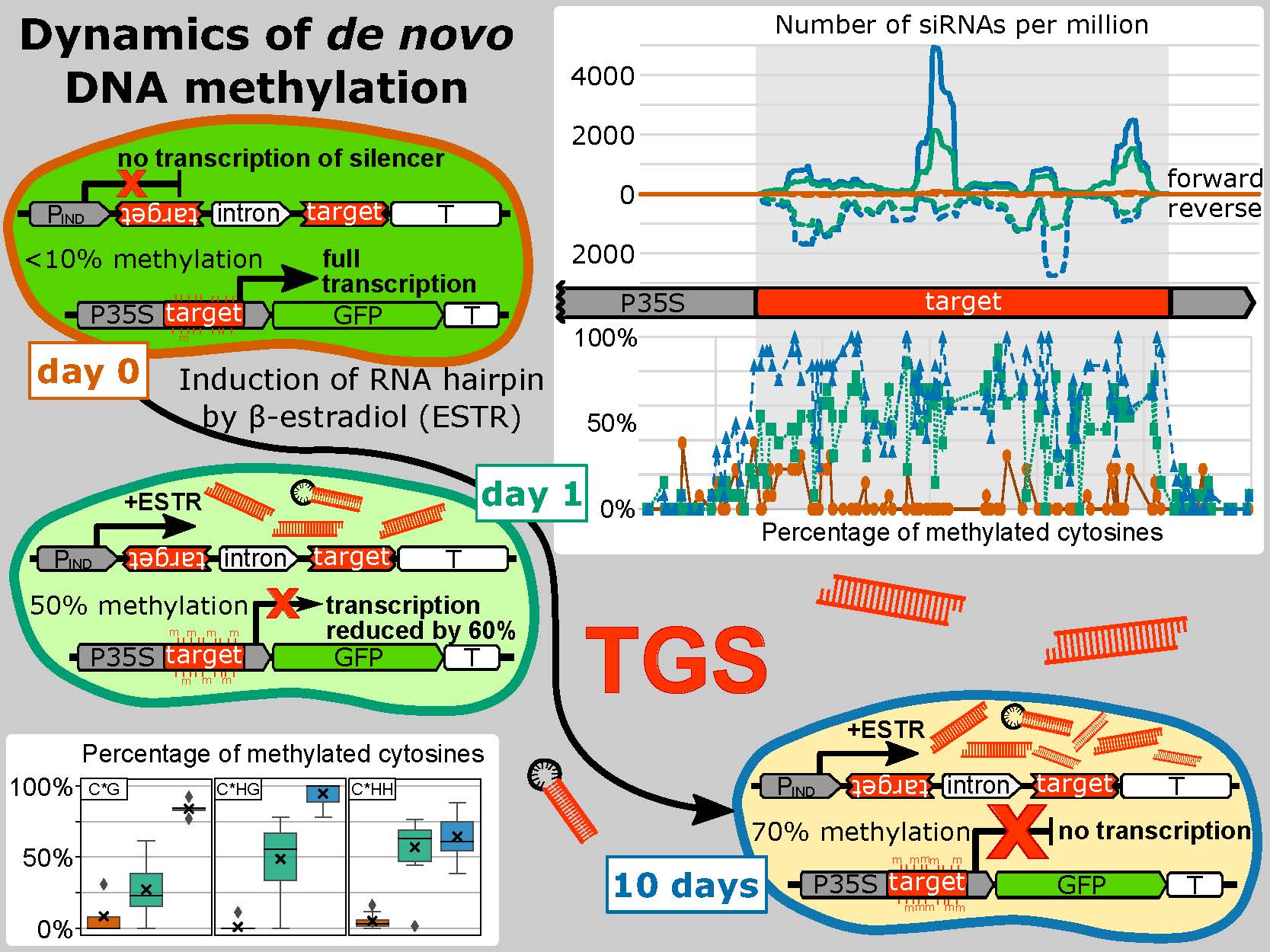 Genetická informace zůstává prakticky identická ve všech buňkách mnohobuněčných organismů v průběhu jejich vývoje a bez ohledu na podmínky prostředí. Aktivitu jednotlivých oblastí genomu je proto nutné pružně regulovat. To platí zejména pro rostliny, které ve svém genomu tolerují velké množství transponovatelných elementů (TE) vmezeřených mezi geny, přičemž podíl TE dosahuje až 85% velikosti genomu. Rostliny jsou také schopny efektivně se vyrovnat s celogenomovými duplikacemi, které jsou hybnou silou jejich evoluce. Pro správné fungování takových genomů si rostliny vytvořily širokou škálu epigenetických nástrojů sloužící ke značení chromatinu jak na úrovni DNA, tak na úrovni histonů. Tyto dráhy jsou navíc navzájem úzce propojeny, což zvyšuje robustnost celého systému. Značení histonů je vysoce komplexní a zahrnuje řadu posttranslačních modifikací histonových konců či různé zastoupení histonových variant v nukleosomech. DNA je značena téměř výhradně metylací cytosinů, jež mohou mít různé role v závislosti na sekvenčním kontextu, ve kterém se nacházejí. Chromatinové značky jsou často jen přechodné nebo snadno revertovatelné, ale mohou být i velmi stabilní a transgeneračně děděné. De novo ustavování epigenetických značek proto musí být dobře opodstatněné a vysoce specifické. Tlumení aktivity chromatinu může být zprostředkované metylací DNA, jež je do aktivních oblastí genomu de novo naváděna pomocí malých RNA (sRNA v komplexu s jejich efektory - proteiny Argonaut, AGO) v procesu nazývaném „RNA-directed DNA methylation“ (RdDM). RdDM, při níž hraje klíčovou roli specifická rostlinná RNA polymeráza V tak propojuje modifikace chromatinu s RNA interferencí (RNAi). RNAi reguluje genovou expresi prostřednictvím sRNA na posttranskripční úrovni. Malé RNA tak mohou umlčovat genovou expresi na transkripční i posttranskripční úrovni (tzv. transcriptional and posttranscriptional gene silencing, TGS/PTGS).
Genetická informace zůstává prakticky identická ve všech buňkách mnohobuněčných organismů v průběhu jejich vývoje a bez ohledu na podmínky prostředí. Aktivitu jednotlivých oblastí genomu je proto nutné pružně regulovat. To platí zejména pro rostliny, které ve svém genomu tolerují velké množství transponovatelných elementů (TE) vmezeřených mezi geny, přičemž podíl TE dosahuje až 85% velikosti genomu. Rostliny jsou také schopny efektivně se vyrovnat s celogenomovými duplikacemi, které jsou hybnou silou jejich evoluce. Pro správné fungování takových genomů si rostliny vytvořily širokou škálu epigenetických nástrojů sloužící ke značení chromatinu jak na úrovni DNA, tak na úrovni histonů. Tyto dráhy jsou navíc navzájem úzce propojeny, což zvyšuje robustnost celého systému. Značení histonů je vysoce komplexní a zahrnuje řadu posttranslačních modifikací histonových konců či různé zastoupení histonových variant v nukleosomech. DNA je značena téměř výhradně metylací cytosinů, jež mohou mít různé role v závislosti na sekvenčním kontextu, ve kterém se nacházejí. Chromatinové značky jsou často jen přechodné nebo snadno revertovatelné, ale mohou být i velmi stabilní a transgeneračně děděné. De novo ustavování epigenetických značek proto musí být dobře opodstatněné a vysoce specifické. Tlumení aktivity chromatinu může být zprostředkované metylací DNA, jež je do aktivních oblastí genomu de novo naváděna pomocí malých RNA (sRNA v komplexu s jejich efektory - proteiny Argonaut, AGO) v procesu nazývaném „RNA-directed DNA methylation“ (RdDM). RdDM, při níž hraje klíčovou roli specifická rostlinná RNA polymeráza V tak propojuje modifikace chromatinu s RNA interferencí (RNAi). RNAi reguluje genovou expresi prostřednictvím sRNA na posttranskripční úrovni. Malé RNA tak mohou umlčovat genovou expresi na transkripční i posttranskripční úrovni (tzv. transcriptional and posttranscriptional gene silencing, TGS/PTGS).
Regulace genové exprese a stavu chromatinu prostřednictvím malých RNA a RNA polymeráz II a V
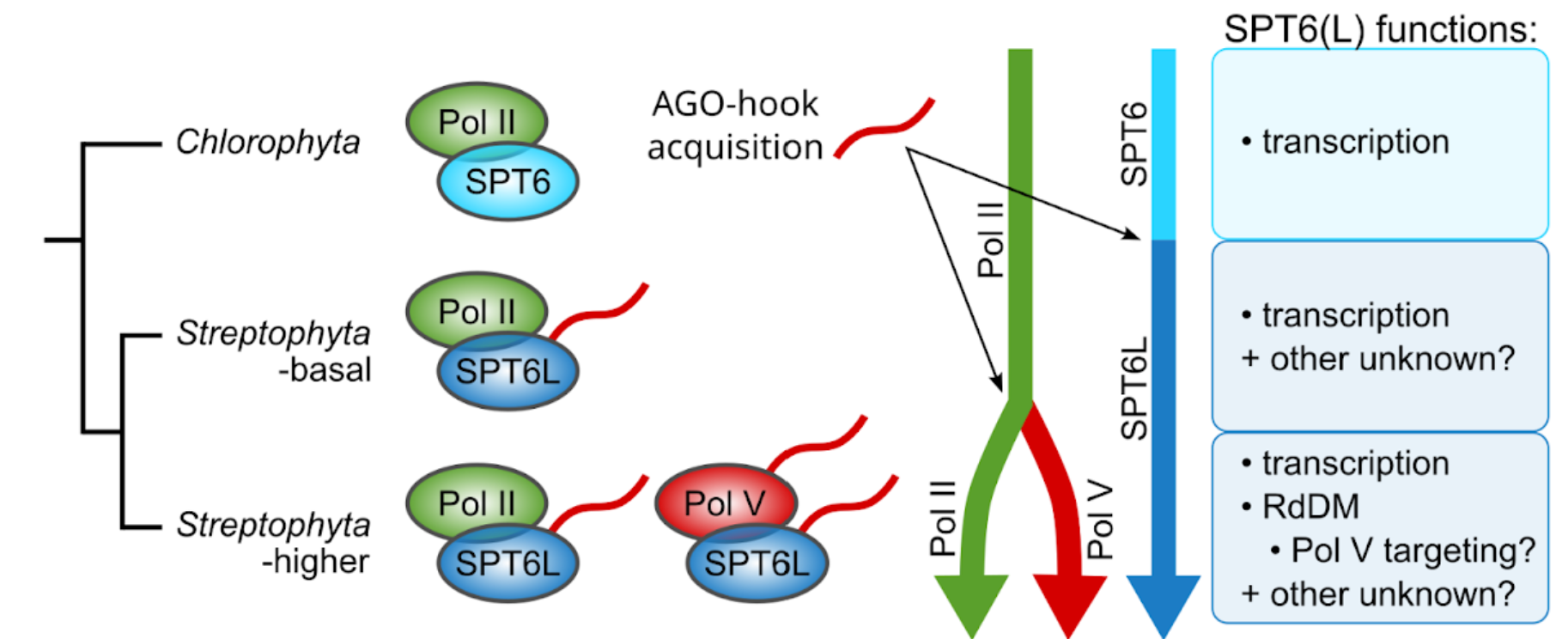 CO UŽ VÍME? Mechanismy zaručující udržování metylace DNA napříč buněčnými děleními jsou relativně dobře popsány. Pro cílení metylace DNA do nemetylovaných oblastí genomu je klíčová RdDM dráha, není ale známo jakým způsobem jsou její složky naváděny do aktivního chromatinu, který má být nově umlčen. Roli by v tomto procesu mohl hrát protein SPT6L, jež je histonovým chaperonem a transkripčním elongačním faktorem Pol II a V a který se může účastnit i iniciace transkripce. U rostlin má SPT6L navíc doménu schopnou vázat proteiny AGO, efektory sRNA. Tato doména se u SPT6L objevila již ve velmi časné fázi rostlinné evoluce, ještě před vznikem RdDM dráhy.
CO UŽ VÍME? Mechanismy zaručující udržování metylace DNA napříč buněčnými děleními jsou relativně dobře popsány. Pro cílení metylace DNA do nemetylovaných oblastí genomu je klíčová RdDM dráha, není ale známo jakým způsobem jsou její složky naváděny do aktivního chromatinu, který má být nově umlčen. Roli by v tomto procesu mohl hrát protein SPT6L, jež je histonovým chaperonem a transkripčním elongačním faktorem Pol II a V a který se může účastnit i iniciace transkripce. U rostlin má SPT6L navíc doménu schopnou vázat proteiny AGO, efektory sRNA. Tato doména se u SPT6L objevila již ve velmi časné fázi rostlinné evoluce, ještě před vznikem RdDM dráhy.
PROČ TO DĚLÁME? Zajímá nás význam této AGO-vazebné domény: Jakou roli hraje v komplexu Pol II? Jakou roli v komplexu Pol V, kde je několik dalších proteinů s podobnou AGO-vazebnou doménou? Mohla by se podílet na navádění Pol V na nemetylované úseky DNA?
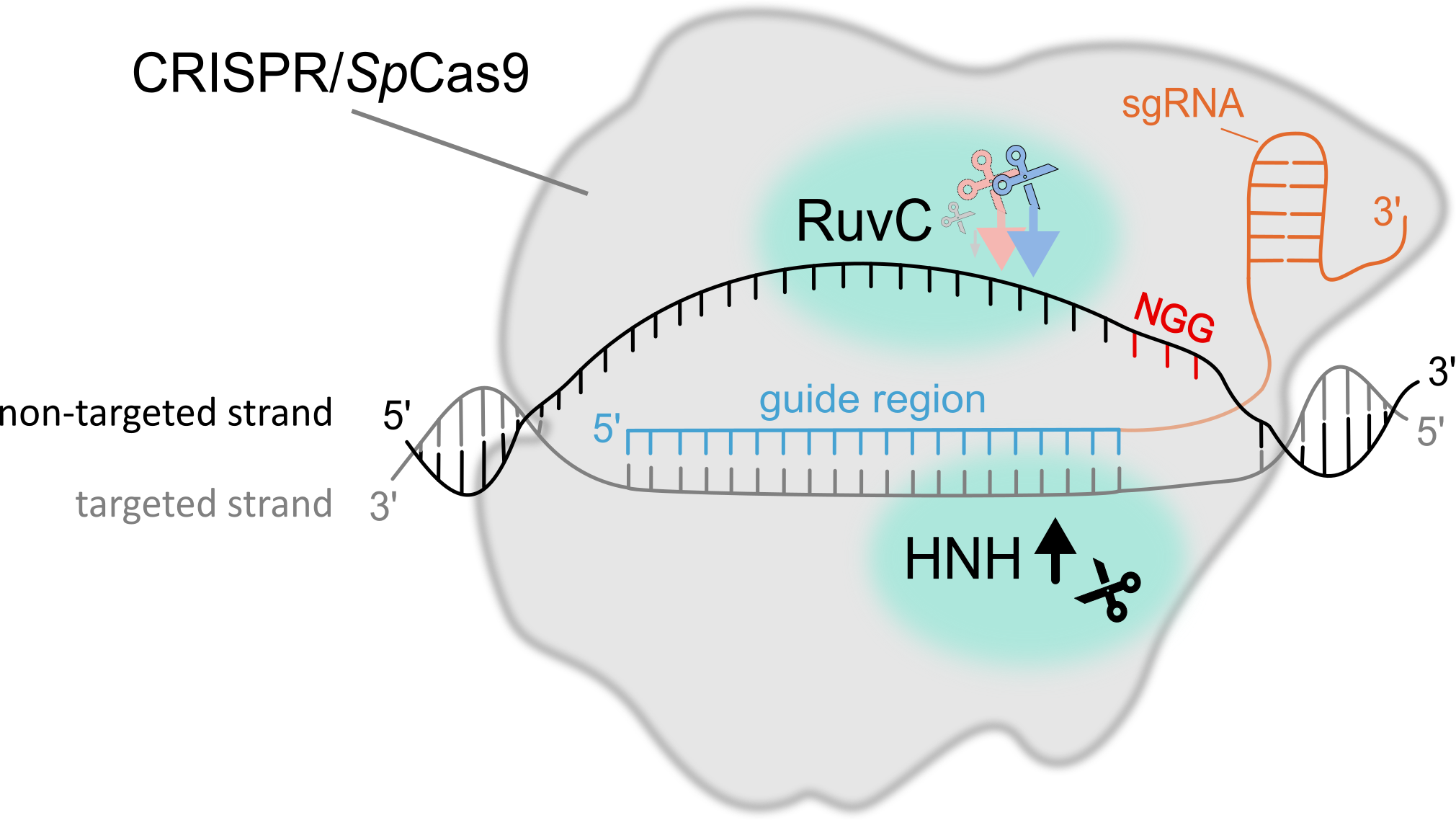
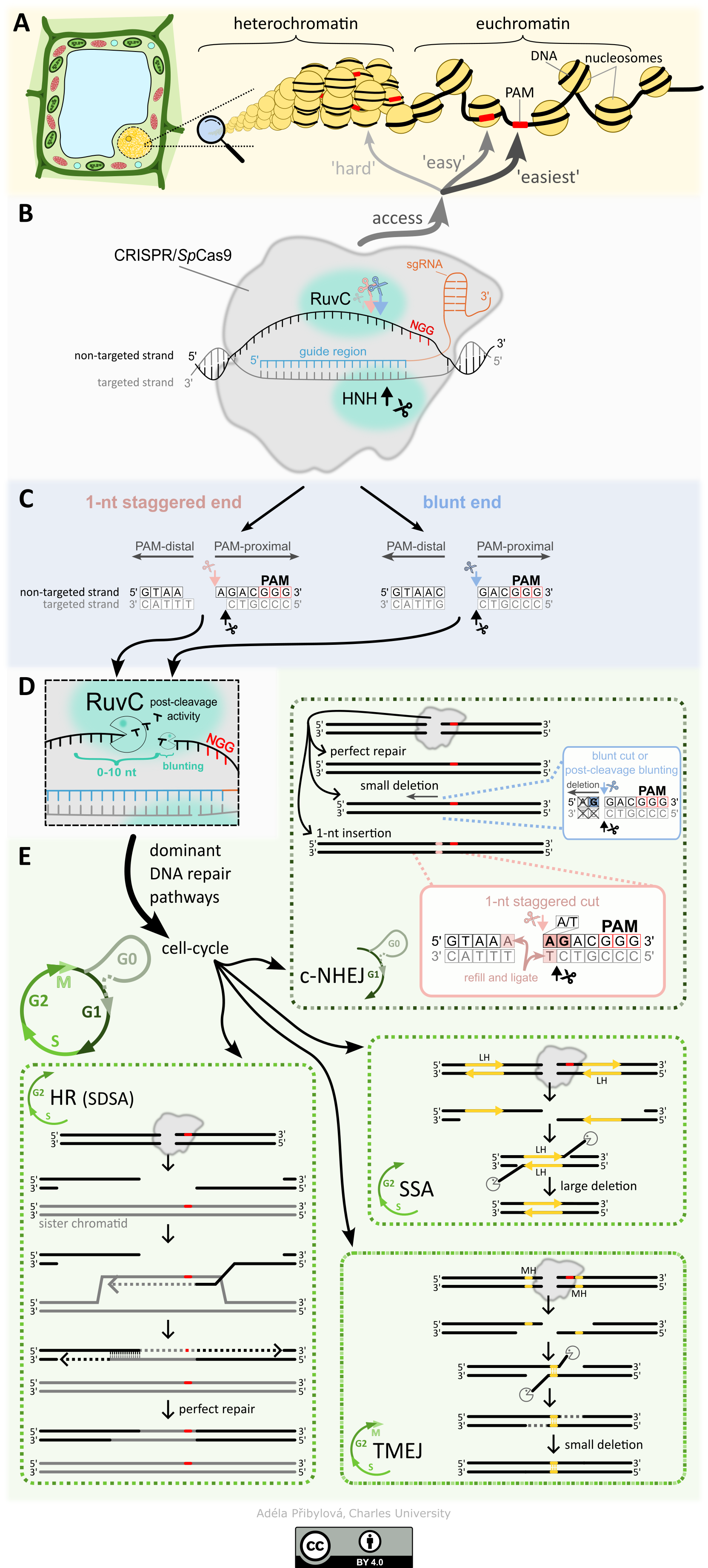
Opravy DNA a CRISPR/Cas mutageneze a jejich ovlivnění malými RNA a stavem chromatinu
PROČ TO DĚLÁME? Systémy CRISPR/Cas se používají v mnoha vědních oborech, od základního výzkumu, kde se využívají například k vytváření knock-outů specifických genů pro studium jejich role, až po aplikovaný výzkum a šlechtění rostlin. Nároky na přesnost techniky a rychlost procesu jsou vysoké, a proto je nezbytné vědět, jak mechanismus CRISPR/Cas funguje, co a jak ovlivňuje jeho vazbu do cílového místa, typ štěpení a jak se rozštěpené místo následně opravuje, a to jak na úrovni jednotlivých buněk tak i tkání. Je totiž známo, že účinnost v jednotlivých místech, ktére jsou od sebe vzdálena i pouhé desítky až nižší stovky nukleotidů zpravidla mívají velmi odlišnou účinnost, a to v řádu i několika desítek procent. Přesnější předvídání výstupů CRISPR/Cas mutageneze tak může snižovat potřebný počet experimentů k dosažení požadovaných výsledků, a tím i výrazně zkrátit čas potřebný na experimenty spolu se snížením celkových nákladů.
CO UŽ VÍME? Mnoho detailů popisujících jednotlivé fáze procesu, od vyhledání cílového místa k editaci po výslednou opravu vytvořeného dvouvláknového zlomu, již bylo dobře popsáno. Málo se však ví jak epigenom ovlivňuje vyhledávání cílových míst, dobu setrvání v cílovém místě, typ štěpení a následnou opravu vzniklého zlomu. Aktuální shrnutí poznatků jak funguje CRISPR/Cas9 systém, co ho ovlivňuje a jak ho používat se můžete dočíst v našem review “How to use CRISPR/Cas9 in plants: from target site selection to DNA repair”.
V naší práci “DNA methylation can alter CRISPR/Cas9 editing frequency and DNA repair outcome in a target-specific manner” jsme popsali jak cílená tvorba siRNA (a následné zanesení epigenetických zneček na DNA) proti promotorové a kódující oblasti reportérového transgenu ovlivňuje výslednou mutagenezi. Naše zjištění naznačují, že metylace DNA (epigenetická značka) může nepřímo narušit aktivitu Cas9 a následnou opravu DNA, pravděpodobně prostřednictvím změn v místní struktuře chromatinu.
CO TEĎ A CO POTOM? V navazujícím výzkumu se věnujeme detailněji jaký vliv má na frekvenci a typ mutace probíhající transkripce nebo přítomnost siRNA. Dále pak zapojení cytoskeletu do jednotlivých oprav dvouvláknových zlomů DNA a jejich vizualizace.
CHCETE VĚDĚT VÍCE, CHCETE SE K NÁM PŘIDAT? Aktuálně máme k tématům vypsanou řadu bakalařských, diplomových a magisterských prací. Pokud máte nápad na své téma, kontaktujte vedoucího týmu Lukáše Fischera či postdoky Adélu Přibylovou a Vojtu Čermáka (e-mailem nebo se stavte přímo v naší laboratoři ve Viničné 5, 2. patro, dveře 210 na konci chodby vlevo).