Mgr. Adéla Přibylová, Ph.D.

Adéla pracuje v laboratoři Molekulární biologie rostlin Lukáše Fischera. Zabývá se epigenetikou a jejím vlivem na mutagenezi CRISPR/Cas a opravy DNA.
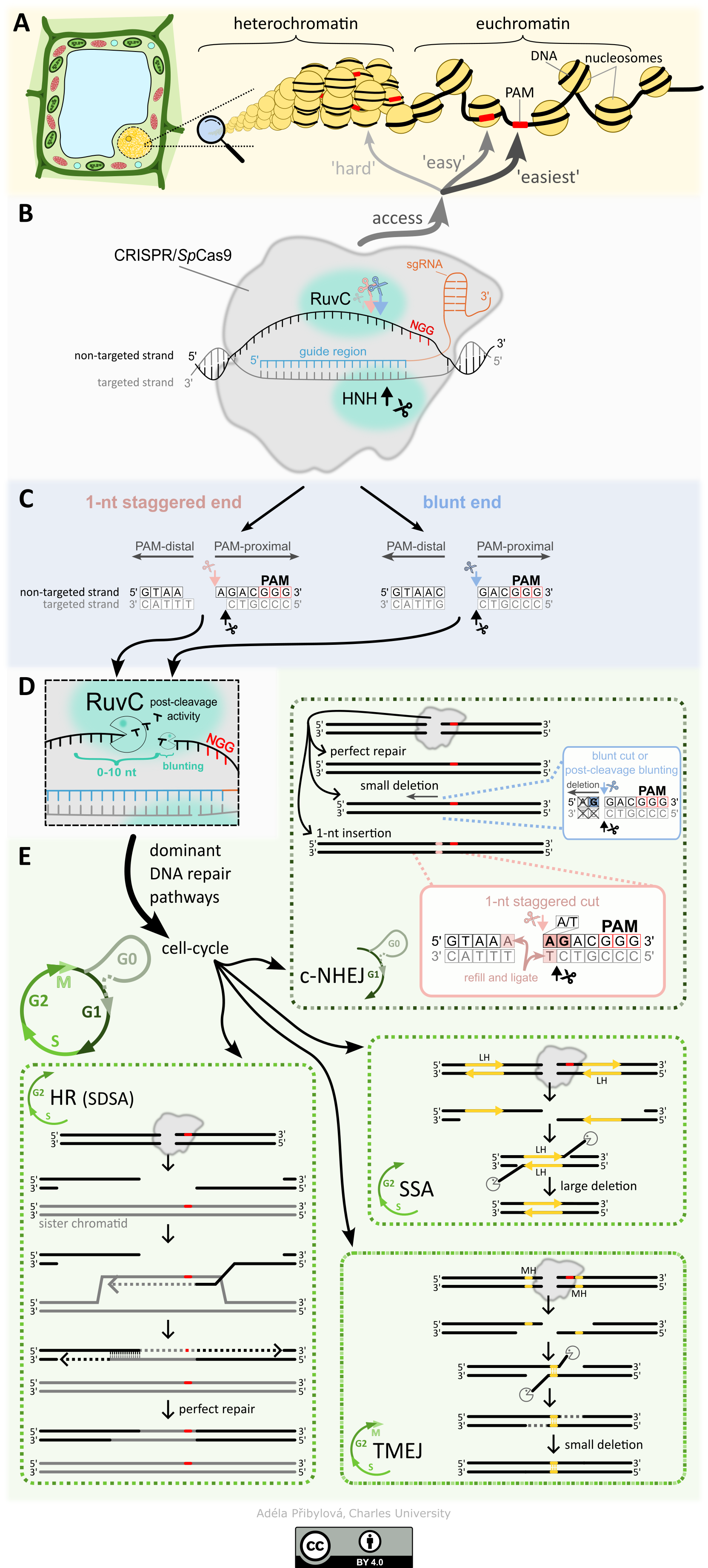
Popis obrázku. Přehled mutageneze CRISPR/SpCas9 v rostlinné buňce.
(A) Obrázek ukazuje dva hlavní stavy chromatinu: euchromatin a heterochromatin. Euchromatin je pro SpCas9 přístupnější než heterochromatin. Podobně je účinnost SpCas9 při vyhledávání sekvence PAM (červený obdelník) vyšší na linkeru DNA než na nukleosomu.
(B) Schematické znázornění CRISPR/SpCas9 navázaného v cílovém místě. Párující vlákno (šedá barva) se páruje s vodicí oblastí (modrá barva) sgRNA (oranžová barva). Štěpení zprostředkovávají endonukleázové domény HNH a RuvC, které stříhají párující a nepárující vlákno.
(C) Zobrazení dvou primárních typů konců DNA vznikajících po štěpení SpCas9. Tupý konec (modrý, vpravo) je štěpen oběma endonukleázovými doménami jen 3 nt před PAM sekvencí. Kohezivní konec (růžový, vlevo) je štěpen 3 nt před PAM na párujícím vlákně a 4 nt před PAM na nepárujícím vlákně. Konce DNA obsahující PAM se označují jako PAM-proximální, zatímco konce bez PAM se označují jako PAM-distální.
(D) Po štěpení může být necílové vlákno dále zpracováno prostřednictvím aktivity RuvC domény (post-cleavage aktivita). PAM-distální konce mohou být zkráceny až o 10 nukleotidů, zatímco PAM-proximální konce mohou být zatupeny, pokud byl primárním štěpením RuvC domény vytvořen kohezivní konec. Rozsah post-cleavage aktivity je určen dobou, po kterou SpCas9 zůstává vázáná v cílovém místě.
(E) Přehled čtyř hlavních drah, které se účastní opravy dvouřetězcových zlomů (DSB; double-strand break) vyvolané SpCas9. Výběr opravné dráhy v buňce je silně ovlivněn fází buněčného cyklu. Dominantní cestou ve fázích G1 a G0 je klasické nehomologické spojování konců (c-NHEJ; classical non-homologous end joining). Jejím výsledkem je buď dokonalá oprava, malá delece (obvykle na distální straně PAM; vyskytuje se hlavně tehdy, když je čtvrtý nukleotid před PAM G), nebo inzerce 1 nukleotidu (většinou duplikace čtvrtého nukleotidu před PAM, zejména když čtvrtý nukleotid je A nebo T a třetí nukleotid je G). Během fází S a G2 mohou být DSB opraveny cestou homologní rekombinace (HR; homologous recombination), jedno vláknové spojování (SSA; single-strand annealing) nebo cestou spojování konců zprostředkovaného polymerázou (TMEJ; polymerase-theta-mediated end joining). HR vyžaduje sesterskou chromatidu nebo jinou předlohu (šedá barva), 5' vlákna konců DNA jsou degradována a obnažený 3' konec vnikne do sesterské chromatidy, která slouží jako předloha pro opravu (schéma ukazuje podkategorii HR synthesis-dependent strand annealing; SDSA) Po prodloužení 3‘ konce podle homologní předlohy se invadující vlákno přemístí a spáruje se se svým komplementárním vláknem z opačné strany DSB; oba 3' konce se prodlouží, aby se vyplnily zbývající mezery, a vzniklá vlákna se slepí (zaligují). Výsledkem HR je obvykle dokonalá oprava. Oprava SSA je zprostředkována přímými repeticemi (dlouhá homologie; LH) kolem DSB. Podobně jako u HR jsou 5' konce DSB degradovány a poté se 3' konce spojují dohromady prostřednictvím oblasti LH. Poté jsou 3' přesahy zkráceny a následuje ligace zbývajících mezer, což vede k větším delecím. Cesta TMEJ využívá krátké (většinou 2-6 nt) mikrohomologie (MH, žlutě) vyskytující se v blízkosti dvouvláknových zlomů. Kromě fází S a G2 buněčného cyklu se vyskytuje také ve fázi M. Při TMEJ jsou krátce degradovány 5' konce, Polθ identifikuje mikrohomologii na opačných stranách dvouvláknového zlomu, 3' přesahy jsou odstraněny a zbývající mezery za 3' konci mikrohomologie jsou vyplněny, následuje ligace jednotlivých mezer. TMEJ vede k malým delecím.
Schéma bylo publikováno v práci: Přibylová A, Fischer L. How to use CRISPR/Cas9 in plants: from target site selection to DNA repair. Journal of Experimental Botany, (2024) 10.1093/jxb/erae147
- ORCID ID:
- 0000-0001-8675-5065
- ResearcherID:
- H-5497-2017
- Scopus Author ID:
- 57210977726





















