Tým Dr. Veroniky Obšilové z Fyziologického ústavu AV ČR a prof. Tomáše Obšila z Katedry fyzikální a makromolekulární chemie Přírodovědecké fakulty Univerzity Karlovy popsali mechanismus regulace enzymu E3 ubikvitin ligasy Nedd4-2. Studie vyšla v prestižním časopise Nature Communications.
Nedd4-2 je klíčový enzym podílející se na regulaci hladiny sodíku tím, že kontroluje odstraňování sodíkových kanálů z buněčných membrán. Tato funkce je zásadní pro regulaci krevního tlaku a osmotické rovnováhy a její narušení souvisí s onemocněními jako je hypertenze, onemocnění ledvin či některé druhy rakoviny. Nová studie týmu z Fyziologického ústavu AV ČR a Přírodovědecké fakulty Univerzity Karlovy poprvé detailně popsala strukturu celého enzymu Nedd4-2 a vysvětlila mechanismus jeho regulace. Pomocí pokročilých zobrazovacích a biochemických metod vědci zjistili, že funkce Nedd4-2 je blokována vzájemnými interakcemi jeho domén. Enzym zůstává neaktivní, dokud se v přítomnosti vápníkových iontů nenaváže na buněčnou membránu. To vede k uvolnění mezi-doménových interakcí a aktivaci Nedd4-2. Studie také ukázala, že na regulaci Nedd4-2 se dále podílejí i proteiny 14-3-3, které reagují na hormonální signály a svojí vazbou blokují jak enzymatickou aktivitu Nedd4-2, tak i jeho schopnost vázat se na membránu.
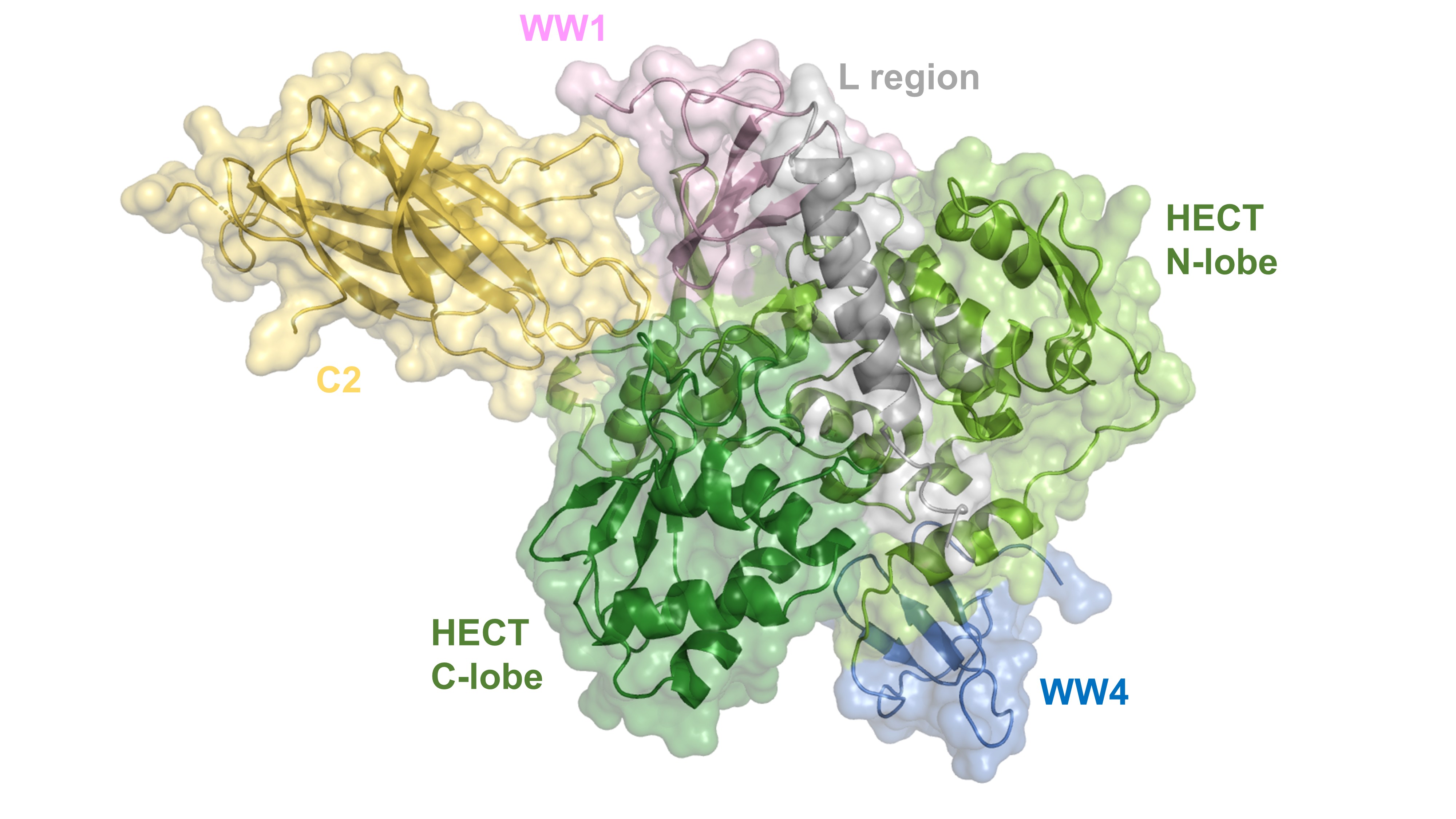
Struktura Nedd4-2 získaná pomocí kryo-elektronové mikroskopie: C2, doména vázající vápník (broskvová); WW1 doména (světle fialová); L oblast (šedá); WW4 doména (modrá); HECT N-lobe, N-lalok katalytické HECT domény (světle zelená); HECT C-lobe, C-lalok katalytické HECT domény (tmavě zelená).
Odkaz na práci: Nat. Comm. 2025, 16, 4875. https://www.nature.com/articles/s41467-025-60207-4





















