Vědci dosáhli významného pokroku v pochopení toho, jak buňky regulují svou vnitřní strukturu. Tým ze tří ústavů Akademie věd České republiky, Ústavu molekulární genetiky, Biotechnologického ústavu a Ústavu organické chemie a biochemie, z Přírodovědecké fakulty Univerzity Karlovy, BIOCEV a CEITEC odhalil molekulární mechanismy proteinu MICAL1, který je klíčový pro udržování tvaru a pohybu buněk. Zjištění výzkumníků přinášejí detailní pohled na fungování MICAL1 při regulaci aktinových filamentů — pružného „skeletu“ buňky — a otevírají nové možnosti pro léčbu nemocí spojených s poruchou této regulace. Studii publikoval prestižní časopis Nature Communications.
Každá buňka v našem těle obsahuje strukturu nazývanou cytoskelet — dynamickou síť proteinových vláken, která buňce poskytuje oporu, umožňuje jí pohybovat se a přizpůsobovat se okolnímu prostředí. Jednou z nejdůležitějších součástí cytoskeletu jsou aktinová vlákna. Tato dlouhá a tenká vlákna proteinu připomínají kabely a výztuže na staveništi a poskytují buňkám pevnost a flexibilitu. Aktinová vlákna jsou nezbytná pro procesy, jako je svalová kontrakce, komunikace nervových buněk a dělení buněk. Aby však cytoskelet mohl tyto funkce plnit efektivně, musí se neustále přizpůsobovat měnícím se potřebám buňky.
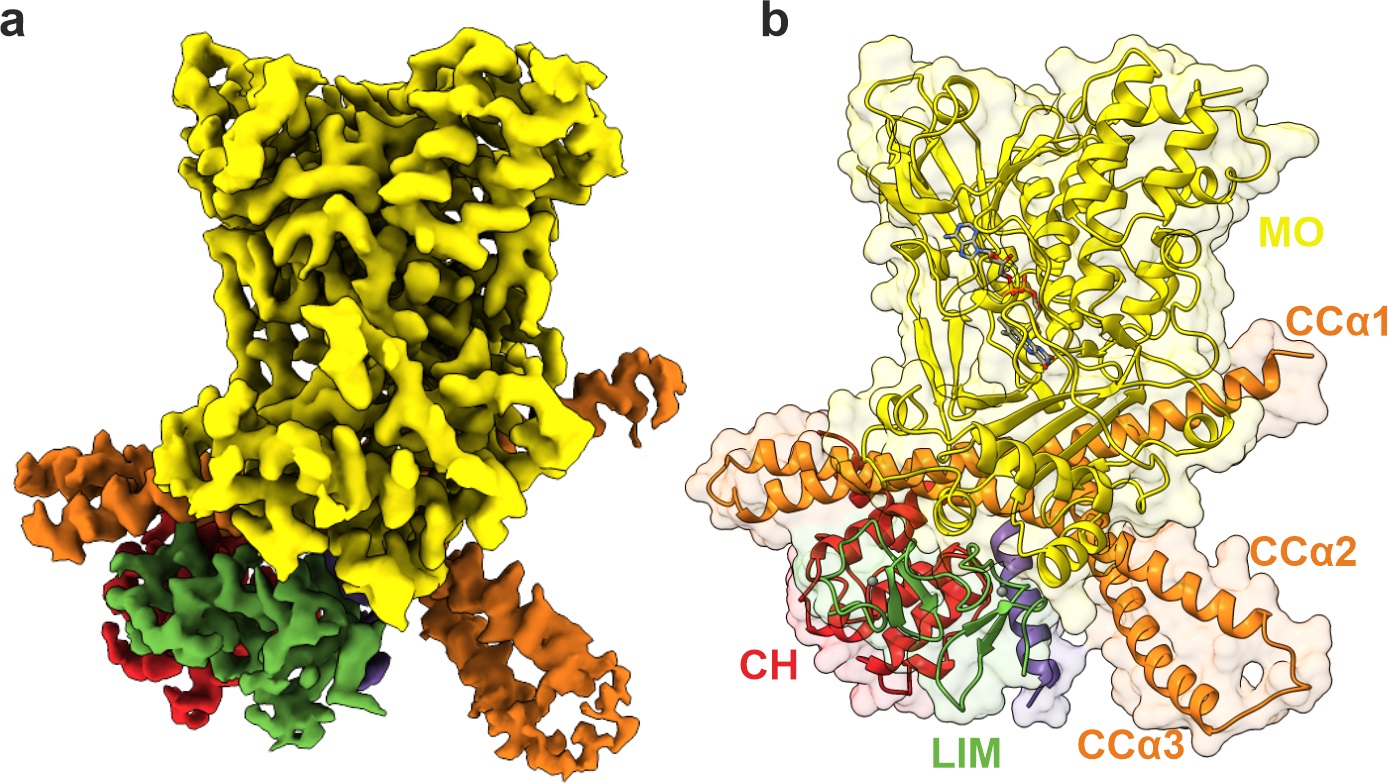
Kryoelektronová mapa proteinu MICAL1 zobrazující jeho tvar a klíčové domény
Rodina proteinů nazývaná MICAL hraje zásadní roli při přetváření aktinových filamentů. Proteiny MICAL působí jako buněčné „nůžky“, které selektivně rozkládají aktinová vlákna, což umožňuje buňkám měnit tvar a pohybovat se podle potřeby. Důležité je, aby proteiny MICAL zůstaly neaktivní, když nejsou potřeba, protože jejich nekontrolovaná aktivita by narušila strukturální integritu buňky. Nová studie v Nature Communications odhaluje, jak MICAL1 zůstává „uzamčený“ ve svém neaktivním stavu, dokud ho buněčný signál nevyzve k činnosti, čímž se předchází nechtěnému poškození vnitřní struktury buňky. Když je MICAL1 aktivován, váže se na aktinová vlákna a rozkládá je procesem nazývaným depolymerizace, což buňce umožňuje upravit tvar a dynamicky reagovat na změny v okolí.
„Použili jsme špičkovou metodu, kryoelektronovou mikroskopii, abychom zobrazili MICAL1 na atomové úrovni a ukázali, že jeho aktivita je přísně řízena specifickými molekulárními interakcemi, které zajišťují, že se aktivuje jen tehdy, kdy je to nezbytné,“ vysvětluje Matej Horváth, první autor studie a v současnosti postdoktorand na Okinawa Institute of Science and Technology. „Bez této regulace by aktivita MICAL1 mohla buňku poškodit, což zdůrazňuje kritickou potřebu přesné kontroly v buněčných procesech.“

neurobiologie
„Tento objev přináší novou naději na pochopení nemocí, které jsou spojeny s patogenními variantami MICAL1,“ říká Daniel Rozbeský, vedoucí Laboratoře strukturní neurobiologie v centru BIOCEV, biotechnologického a biomedicínského centra AV ČR a Univerzity Karlovy. „Naše kryoEM struktura naznačuje, že u některých pacientů s určitým typem epilepsie dochází k hyperaktivitě patogenních variant MICAL1 způsobené selháním udržení neaktivního stavu. Do budoucna plánujeme zkoumat způsoby, jak obnovit správnou regulaci MICAL1, což by mohlo přinést úlevu pacientům trpícím touto nemocí.“
Horvath, M., Schrofel, A., Kowalska, K. et al. Structural basis of MICAL autoinhibition. Nat Commun 15, 9810 (2024). https://doi.org/10.1038/s41467-024-54131-2





















